ALQUINOS 1
A continuación mi repaso sobre ALQUINOS y AROMATICOS.




ALQUINOS 2



Hidrocarburos aromáticos 1




Hidrocarburos Aromaticos 2



















- Es un sólido a temperatura ambiente.
- Es el pilar básico de la química orgánica
- Así, con el oxígeno forma el dióxido de carbono, vital para el crecimiento de las plantas, con el hidrógeno forma numerosos compuestos denominados genéricamente hidrocarburos.
- El silicio es el segundo elemento más abundante de la corteza terrestre (27,7% en peso) Se presenta en forma amorfa y cristalizada
- En forma cristalina es muy duro y poco soluble y presenta un brillo metálico y color grisáceo
- Aunque es un elemento relativamente inerte y resiste la acción de la mayoría de los ácidos, reacciona con los halógenos y álcalis diluidos.
- Se utiliza en aleaciones, en la preparación de siliconas y en la industria cerámica.
- Se usa como revestimiento protector del cobre, del hierro y de diversos metales usados en la fabricación de latas de conserva.
- Forma aleaciones con muchos metales como el calcio estaño y bronce, y, en general, se emplea en esta forma en la mayor parte de sus aplicaciones
- Es un metal pesado y tóxico, y la intoxicación por plomo se denomina saturnismo o plumbosis.
- Es un metaloide sólido duro, cristalino, de color blanco grisáceo lustroso, quebradizo, que conserva el brillo a temperaturas ordinarias.
- Forma gran número de compuestos organometálicos y es un importante material semiconductor utilizado en transistores y foto detectores.
- El nitrógeno es el componente principal de la atmósfera terrestre
- Está presente también en los restos de animales
- Tiene una elevada electronegatividad.
- Sus principales aplicaciones son industriales, por su baja reactividad.
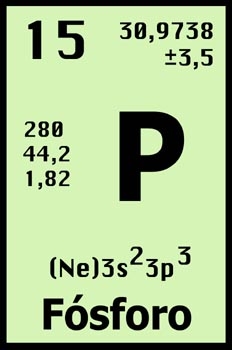
- No metal multivalente
- Se encuentra en la naturaleza en fosfatos inorgánicos y en organismos vivos pero nunca en estado nativo.
- Tiene una muy alta reactividad.
- Forma parte de las moléculas de ADN y ARN, las células lo utilizan para almacenar y transportar la energía
- Funciona como un agente desecante absorbiendo la humedad del aire.
- Es muy común en la atmósfera, en rocas y suelos, en la hidrosfera la biosfera.
- Es un elemento químico esencial para la vida aunque tanto el arsénico como sus compuestos son extremadamente venenosos.
- Se presenta de forma sólida en raras ocasiones
- Es preservante de la madera
- No es un elemento abundante en la naturaleza, rara vez se encuentra de forma natural.
- El antimonio en su forma elemental es un sólido cristalino, fundible, quebradizo, blanco plateado que presenta una conductividad eléctrica y térmica baja y se evapora a bajas temperaturas.
- Este elemento semimetálico tiene cuatro formas alotrópicas. En su forma estable es un metal blanco azulado. El antimonio negro y el amarillo son formas no metálicas inestables.
- El antimonio tiene una creciente importancia en la industria de semiconductores
- Usado como aleante

- Es un metal trivalente pobre, puede producirse naturalmente sin combinar, aunque su sulfuro y oxido forman importantes minerales y óxidos.
- Es un metal quebradizo con un color blanco plateado cuando está recién producido.
- Su toxicidad es mucho menor que sus vecinos de la tabla periódica como el plomo.

- Es el elemento mas abundante del planeta y existe en todos los tres estados; Solido, Liquido y Gaseoso.
- Esta sustancia comprende una importante parte de la atmósfera y resulta necesaria para sostener la vida terrestre
- Se obtiene mediante la destilacion fraccionada del aire.

- Se encunetra en zonas volcanicas y en domos de sal.
- Es mal conductor de calor y no conduce electricidad

- Se encuentra como impureza en los depositos de azufre.
- Presenta un aspecto metalico, Es un semimetal y es fotoconductor.
- Se obtiene del tueste de minerales sulfurosos
- No es muy abundante en la naturaleza se encuentra como teluros de plata y oro como impurezas del sulfato de cobre.
- El telurio es un elemento relativamente estable, insoluble en agua y ácido clorhídrico, pero soluble en ácido nítrico y en agua regia
- Es un metaloide con propiedades de caracter no metalico.
- Es un metaloide radiactivo muy escaso, que emite radiacion alfa y gamma.
- Esta sustancia radiactiva se disuelve con mucha facilidad en ácidos, pero es sólo ligeramente soluble en alcalinos
- Es extremadamente tóxico y altamente radiactivo.